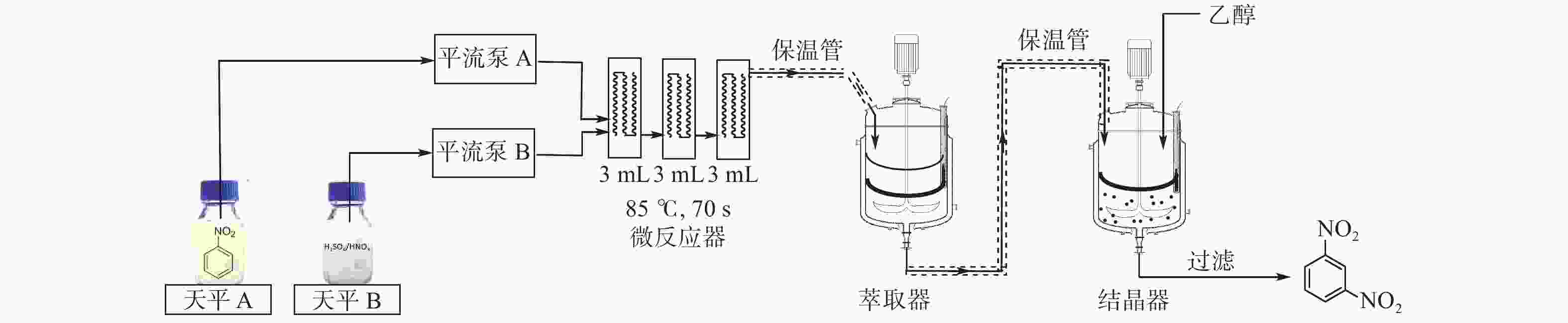
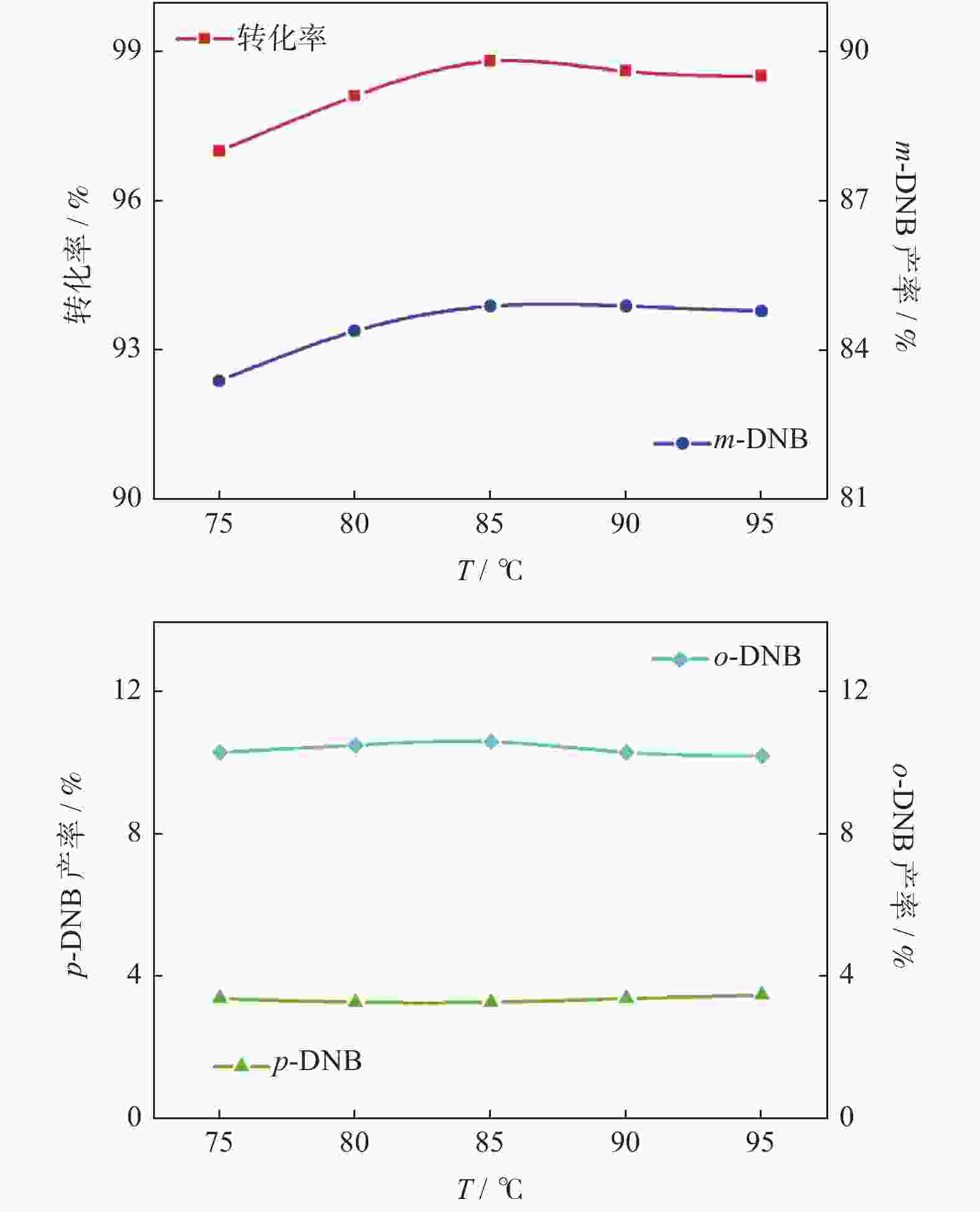
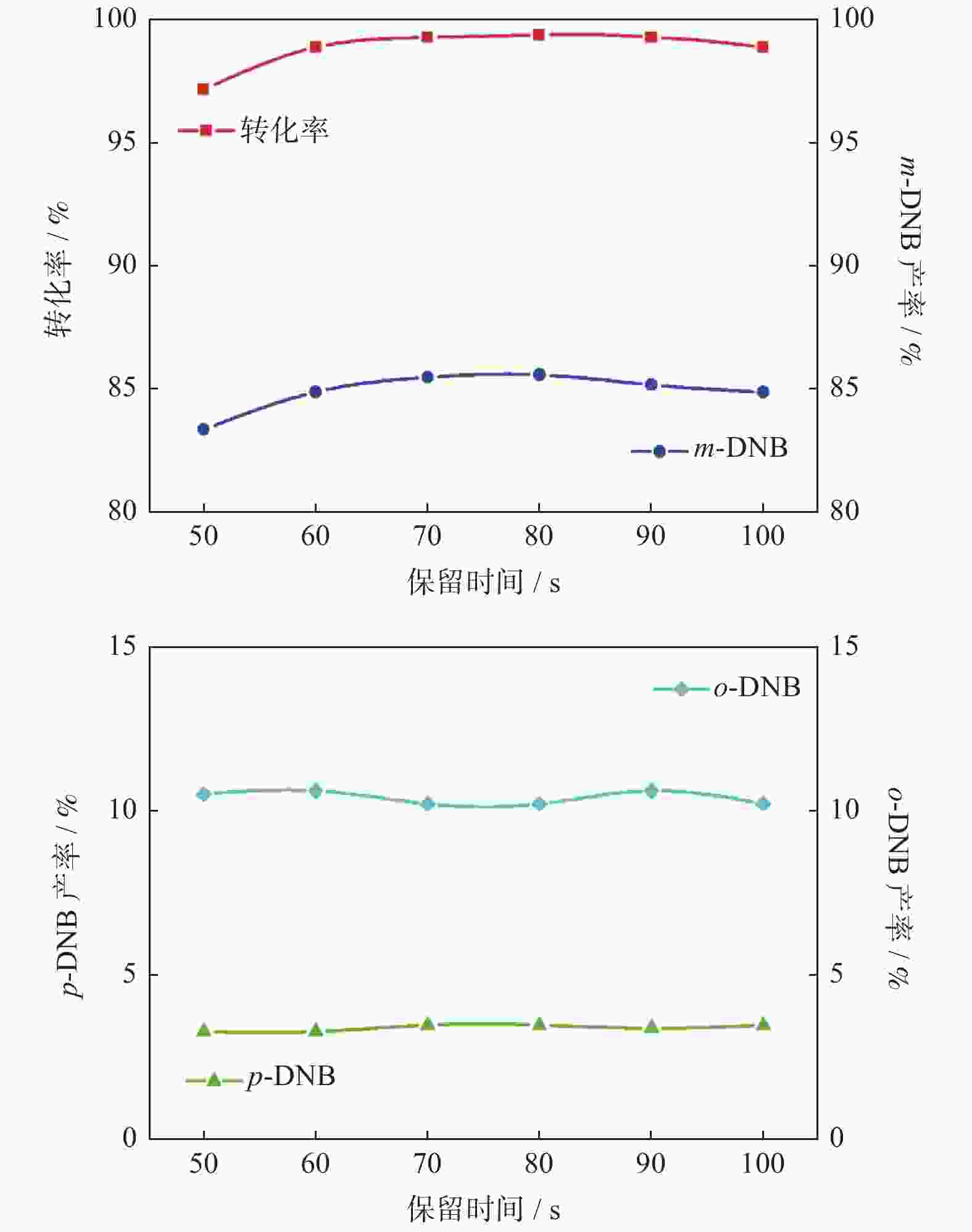
|
[1]
|
AITKEN K M, AITKEN R A. ChemInform abstract: Nitroarenes[J] . Science of Synthesis,2009,40(27):1183.
|
|
[2]
|
BEDEKOVIC D, POOL J L, WILLIAMS B J, et al. Process for the manufacture of fluoran: US19910769741[P]. 1991-09-30.
|
|
[3]
|
HENSHALL J B, WALSH S, WHITWORTH J, et al. Production of 3- and 4-(disubstituted amino) phenols without continuous monitoring of Ph: EP831081[P]. 1997-09-11.
|
|
[4]
|
HARUHISA H, HIROSHI M, SHIGERU S. Process for preparing N-Alkylaminophenols: EP0218350[P].1986-08-26.
|
|
[5]
|
SMITH K, GIBBINS T, MILLAR R W, et al. A novel method for the nitration of deactivated aromatic compounds[J] . Journal of Chemical Society,2000,16:2753 − 2758.
|
|
[6]
|
MELHUISH M W, MOODIE R B. Electrophilic aromatic substitution. Part 35. Chlorination of 1,3-dinitrobenzene, 1-chloro-2,4-dinitrobenzene, and 2,4-dinitrotoluene with nitric acid and hydrogen chloride or chlorine in sulphuric acid or oleum[J] . Journal of Chemical Society,1989(6):667 − 673.
|
|
[7]
|
BROCKLEHURST C E, LEHMANN H, VECCHIA L L. Nitration chemistry in continuous flow using fuming nitric acid in a commercially available flow reactor[J] . Organic Process Research and Development,2011,15(6):1447 − 1453.
|
|
[8]
|
王士玉. 硝基苯连续硝化生产混二硝基苯工艺: CN 101343229A[P]. 2009-01-14.
|
|
[9]
|
RAHAMAN M, MANDAL B,GHOSH P. Nitration of nitrobenzene at high‐concentrations of sulfuric acid: Mass transfer and kinetic aspects[J] . AIChE Journal,2010,56(3):737 − 748.
|
|
[10]
|
YU Z Q, ZHOU P C, LIU J M, et al. Continuous-Flow process for selective mononitration of 1-methyl-4-(methylsulfonyl) benzene[J] . Organic Process Research and Development,2016,20(2):199 − 203. doi: 10.1021/acs.oprd.5b00374
|




 下载:
下载: