|
[1]
|
QUAN L N, RAND B P, FRIEND R H, et al. Perovskites for next-generation optical sources[J] . Chemical Reviews,2019,119(12):7444 − 7477. doi: 10.1021/acs.chemrev.9b00107
|
|
[2]
|
WANG C, DONG H, JIANG L, et al. Organic semiconductor crystals[J] . Chemical Society Review,2018,47(2):422 − 500. doi: 10.1039/C7CS00490G
|
|
[3]
|
HEDLEY G J, RUSECKAS A, SAMUEL I D W. Light harvesting for organic photovoltaics[J] . Chemical Reviews,2017,117(2):796 − 837. doi: 10.1021/acs.chemrev.6b00215
|
|
[4]
|
XIE Q Y, QU Y, WANG G L, et al. New bipolar host materials based on isoquinoline and phenylcarbazole for red PhOLEDs[J] . Dyes and Pigments,2022,205:110559. doi: 10.1016/j.dyepig.2022.110559
|
|
[5]
|
LUO J, XIE Z, LAM J W Y, et al. Aggregation-induced emission of 1-methyl-1, 2, 3, 4, 5-pentaphenylsilole[J] . Chemical Communications,2001(18):1740 − 1741.
|
|
[6]
|
XU W H, WANG D, TANG B Z. NIR-II AIEgens: A win-win integration towards bioapplications[J] . Angewandte Chemie International Edition,2021,60(14):7476 − 7487. doi: 10.1002/anie.202005899
|
|
[7]
|
CUI L, BAEK Y, LEE S, et. al. An AIE and ESIPT based kinetically resolved fluorescent probe for biothiols[J] . Journal of Materials Chemistry C,2016,4(14):2909 − 2914. doi: 10.1039/C5TC03272E
|
|
[8]
|
ZHANG J, XU B, CHEN J, et. al. Oligo(phenothiazine)s: Twisted intramolecular charge transfer and aggregation-induced emission[J] . The Journal of Physical Chemistry C,2013,117(44):23117 − 25. doi: 10.1021/jp405664m
|
|
[9]
|
CHEN H, QU Y, LUO X, et. al. Dual model fluorescent probe for BSA and tetracycline derivatives based on dipyridinyltriphenylamine and indole-fused-naphthalimide[J] . Dyes and Pigments,2022,206:110619. doi: 10.1016/j.dyepig.2022.110619
|
|
[10]
|
LUO X, QU Y, ZHANG Y, et. al. The flexibility of side chains for adjusting the emission of 4-aryl-1, 8-naphthalimides in aggregation: Spectral study and cell imaging[J] . Chemical Engineering Journal,2021,415:129095. doi: 10.1016/j.cej.2021.129095
|
|
[11]
|
ZHANG Y, QU Y, ZHU Y, et al. Bisnaphthalimide-based fluorescent sensor for detecting alcohol and application in evaluating the liquors[J] . Journal of Luminescence,2019,214:116573. doi: 10.1016/j.jlumin.2019.116573
|




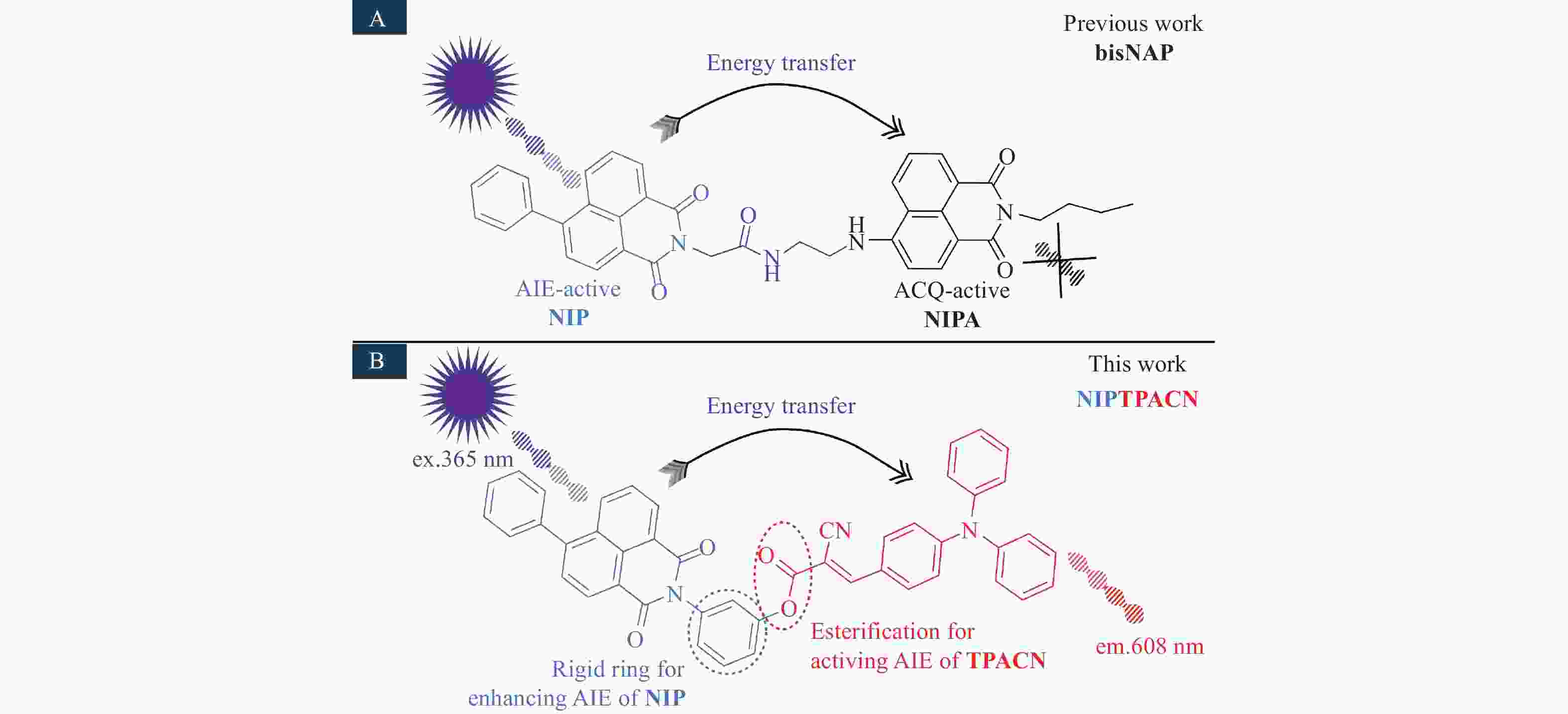
 下载:
下载: